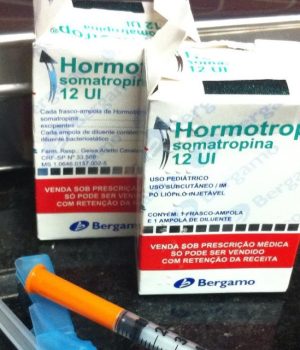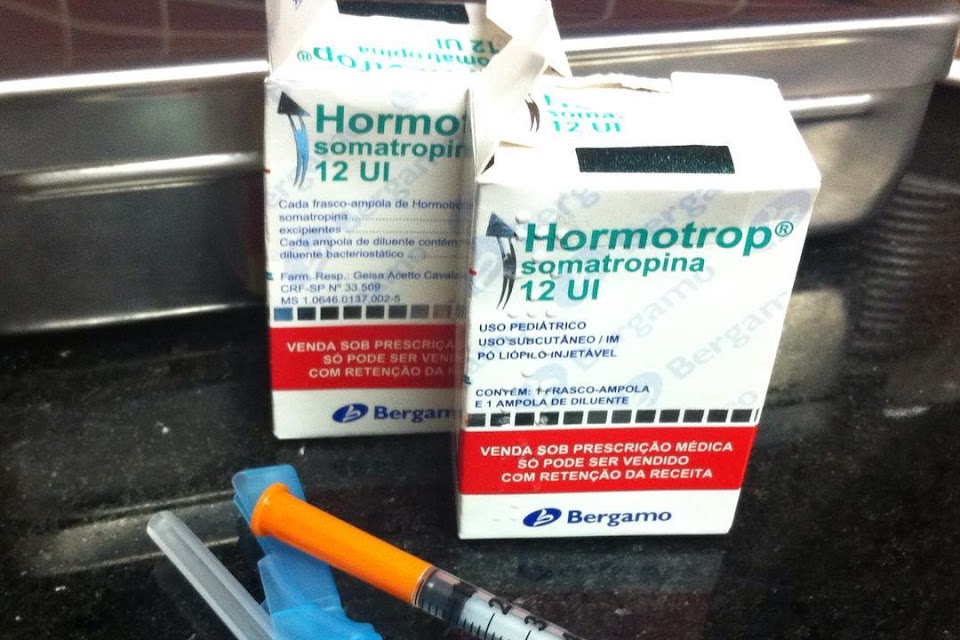
O hormônio Hormotrop indicado no tratamento de crianças com problemas de crascimento é um dos mais falsificados. O preço varia entre R$ 250 a R$ 120 nas farmácias e internet e o consumidor não tem como saber se o produto é original ou falsificado. O remédio é o recordista de interdições e na lista do portal da Anvisa aparece 34 Resolução de Recolhimento de falsificações que foram detectadas e denunciadas pelo dono da patente. O anabolizante também é muito utilizado como bomba por fisiculturistas e praticantes de academia para aumentar a musculatura.
O portal da Anvisa apresenta milhares de medicamentos interditados entre 2007 a 2024 por irregularidades como erros ou fraudes na fabricação e falsificações. A maioria das resoluções tem base em denúncias ou informações repassadas por terceiros, como laboratórios estaduais que fazem testes em remédio que teve queixa de ineficácia por parte do usuário. Com esse padrão de funcionamento fica claro que a Anvisa não cumpre o seu papel, que é fiscalizar.
Praticamente todas as resoluções de Anvisa entre 2007 a 2024 referentes ao recolhimento de medicamentos falsos como o hormônio Hormotrop, Dualid-S e Desobesi-M, do Cialis e Viagra, Glifag e tantos outros partiram de denúncias feitas pelos donos das patentes que detectaram as irregularidades, nunca por análises prévias da própria Anvisa.

Medicamentos caros como o Viagra e o Cialis (indicados para disfunção erétil) estão entre os que mais aparecem na portal da Anvisa com Resolução de Interdição baseadas nas denúncias feitas pelos laboratórios donos das marcas.
Nas listas de Resolução da Anvisa (com determinação de proibição e recolhimento) aparecem muitos medicamentos utilizados no tratamento ou controle de doenças graves como infarto e AVC, antidepressivos como o Diazepan, várias interdições por fraudes na formulação de medicamentos genéricos anti-hipertensivos que estão entre os mais usados pela população como o Atenolol, Losartana, Captopril e Hidroclorotiazida, além de antibióticos de vários laboratórios (variadas apresentações) e anticoncepcionais de uso oral e injetável.
A maioria das fraudes na composição dos remédios que aparecem na listagem da Anvisa teve como base os testes feitos por laboratórios estaduais (Lacens). Também esses testes, no brasil, quase sempre acontecem movidos por denúncias de pacientes ou médicos que observaram ineficácia ou complicações no uso da medicação.
Vale ressaltar que a maior parte dos medicamentos interditados são produzidos por laboratórios de capital nacional que fazem conluio com as farmácias para favorecerem a venda dos seus produtos. Conhecida no setor farmacêutico como política da empurroterapia, a propina ou bonificação paga aos balconistas e farmacêuticos viciam o atendimento nos balcões da maioria das mais de 70 mil farmácias existentes no país.
É unânime entre os especialistas da área da saúde e a classe médica que o conluio entre os laboratórios, farmácias, balconistas e farmacêuticos causa graves distorções no aviamento da receita e como consequência no tratamento previsto pelo médico e esperado pelo paciente. O problema vai além da questão ética e acena para questões como ‘Por que o tratamento não surtiu o efeito esperado?’ ‘A avaliação da doença estava correta?’ ‘Por que o paciente não melhora e o quadro da doença só piora?’ Em situações como essas, quando o paciente retorna ao consultório, muitas vezes o médico fica sem saber o que fazer.
O médico e coordenador da Sobravime (Sociedade Brasileira de Vigilância dos Medicamentos) José Ruben de Alcântara Bonfim considera que “é comum o paciente chegar na farmácia com uma receita de um medicamento A o balconista vender um remédio B. Em casos como esse, como o médico pode assumir responsabilidade pela prescrição da sua receita? Existe uma deturpação muito grave no aviamento das receitas nas farmácias. E eu tenho observado esse problema há mais de trinta anos, falo isso porque só comecei a observar o problema quando entrei na faculdade medicina, mas esse problema é muito grave e muito antigo no Brasil e parece que nunca vai acabar. É lógico que tudo isso só acontece por causa dos interesses comerciais que existem por trás da venda dos medicamentos”.
O comércio de medicamentos no país tem lucros inimagináveis alavancados pela bonificação dos medicamentos, que deslancha a empurroterapia nos balcões das farmácias. Essa prática desleal contra os pacientes e consumidores nasceu como política comercial dos primeiros pequenos laboratórios de capital nacional para enfrentar a concorrência com as indústrias farmacêutica multinacionais. E com a falta de fiscalização e permissividade da Anvisa o problema persiste até hoje.
“A prescrição do médico tem que ser obedecida. Não existe nada que justifica a troca da prescrição por um leigo que atende no balcão da farmácia ou drogaria. É uma interferência grave que desqualifica o tratamento da doença proposto pelo médico e em consequência coloca em risco a vida do paciente. A única possibilidade possível é a troca do medicamento de referência por um correspondente genérico”, ressalta José Ruben.
Descaso da Anvisa para as fraudes em medicamentos
O trabalho da Anvisa quase sempre é receber as queixas, reclamações e denúncias e publicar a Resolução de interdição ou proibição. O pior de tudo é que a Anvisa não fiscaliza se os produtos com irregularidades ou oriundos de fraudes e falsificação efetivamente estão sendo retirados das prateleiras das farmácias, postos de saúde, farmácias, postos de saúde e hospitais públicos (e particulares).
 Doutor em Saúde Coletiva, Jarbas Barbosa ocupa o cargo político de diretor-presidente da Anvisa desde 2015: falta de fiscalização e vistas grossas para as fraudes e aberrações aconteçam no setor farmacêutico
Doutor em Saúde Coletiva, Jarbas Barbosa ocupa o cargo político de diretor-presidente da Anvisa desde 2015: falta de fiscalização e vistas grossas para as fraudes e aberrações aconteçam no setor farmacêutico
O trabalho da Anvisa é basicamente receber as denúncias e publicar a determinação para o laboratório que fabricou recolher o produto. No entanto não existe fiscalização da Anvisa para garantir que os medicamentos fraudulentos sejam realmente recolhidos das prateleiras das mais de 70 mil farmácias em todo o país.
Vale lembrar que a enxurrada de medicamentos ineficazes interditados, conforme mostram as listas da Anvisa, também foram vendidos para a maioria das prefeituras do país. Os medicamentos de má qualidade foram na totalidade distribuídos nos postos de saúde e hospitais públicos (muitos deles também são utilizados em hospitais de capital privado).
É pouco provável que parcela mínima dos medicamentos com indícios de fraude estejam sendo retirada do mercado. Prova disso é que nem a Anvisa e nenhuma das vigilâncias sanitárias municipais e estaduais procuradas têm documentação ou qualquer tipo de controle sobre a coleta dos medicamentos que, segundo os representantes dos órgão públicos de fiscalização “é responsabilidade dos próprios laboratórios fazer o recolhimento através da inversão do caminho feito para o recebimento da mercadoria”.
Ao ser questionado por emails (cinco no total sem respostas) e procurado na sede em Brasília para responder às questões sobre os graves problemas acerca dos medicamentos, o diretor-presidente da Anvisa Jarbas Barbosa, se esquivou em falar das fraudes, falsificações e medicamentos contrabandos vendidos à rodo de norte a sul do país. O presidente da Anvisa também não quis falar —nem indicar um representante— sobre a venda do Cytotec (livre na internet) em farmácias e barracas de camelô para o aborto; também não quis falar das anfetaminas contrabandeadas do Paraguay e vendidas em farmácias, internet, feiras livres e barracas de camelôs para o tratamento da obesidade e especificamente vendidas em bares, lanchonetes, restaurantes e até borracharias de beira de estradas a caminhoneiros como “arebites”; o presidente da Anvisa —também doutor em saúde coletiva e o ocupante do cargo de indicação política— como bagre no anzol também não respondeu porque a Agência não faz testes por amostragem para detectar os medicamentos fraudulentos existentes nas prateleiras das farmácias; liso como bagre o presidente da Anvisa também não quis responder porque não existe nas visas procuradas comprovações do recolhimento dos medicamentos por ela interditados (nenhuma das vigilâncias municipais e estaduais procuradas —municipal e estadual em Foz do Iguaçu e, Fazenda Rio Grande e Toledo; municipal e estadual em Curitiba; municipal e estadual em São Paulo e estadual no RJ possui cópia dos laudos do recolhimento de medicamentos nas farmácias feito por fiscais ou por representantes dos laboratórios detentores das patentes). Liso como o bagre, Barbosa também não quis responder por que a Anvisa credenciou (de forma descaradamente antiética) o laboratório Biocinese (de Toledo) para emitir laudos satisfatórios para obtenção de registros de medicamentos ao laboratório Pratti Donaduzzi (também de Toledo) já que são propriedades do mesmo dono. Muitas outras questões incluindo irregularidades e indícios de corrupção na Anvisa e nos seus braços (visas municipais e estaduais) estão sem as respostas do atual presidente do órgão governamental que foi criado para proteger a população —principalmente— dos fraudadores de medicamentos. No entanto, o que vemos, é a incompetência, negligência e corrupção na Anvisa —a Agência não passa na auditoria de qualquer contador recém-formado— que só favorece os laboratórios e falsificadores de medicamentos.
Listas de medicamentos interditados:
1 – Lista medicamentos irregulares entre 2009 a 2014;
2 – Lista medicamentos interditados publicada em 2014;
3 – Lista de medicamentos interditados publicada em janeiro de 2017:
4 – Lista de medicamentos interditados publicada em maio 2017:
5 – Lista de suspensão 13 lotes anticoncepcionais Gynera em junho de 2017;
6 – Lista de suspensão 45 lotes genéricos para infarto e AVC em junho de 2017;
7 – Portal da Anvisa – 3049 páginas com listas de medicamentos, fitoterápicos e alimentos interditados por irregularidades ou falsificação entre 2010 a 2017;
Veja os principais medicamentos interditados por erros de fabricação, fraudes graves e falsificacão:
Empresa: ACHÉ LABORATÓRIOS FARMACÊUTICOS S.A. Produto: BIOMAG 15 mg (cloridrato de sibutramina) Lote, fabricação e validade: 1310710-4 (validade 10/2018) Diferenças: A empresa detentora do registro do medicamento não fabricou o lote desse produto com características de validade 10/2018, tratando-se, portanto, de falsificação.Informações Adicionais: Apreensão e inutilização das unidades do lote do medicamento. Empresa: LABORATÓRIO QUÍMICO FARMACÊUTICO BERGAMO LTDA. Produto: HORMOTROP 12 UI pó liofilizado + diluente Lote, fabricação e validade: CC40793 e CC60602 Diferenças: A empresa detentora do registro do medicamento identificou e confirmou no mercado a presença de unidades dos lotes citados, os quais não são de procedência da mesma, tratando-se portanto, de falsificação.Informações Adicionais: Proibição da distribuição, comércio e uso, bem como a apreensão e inutilização.Resolução Específica nº : 01423/2015Data de publicação : 12/05/2015.Empresa: ACHÉ LABORATÓRIOS FARMACÊUTICOS S.A. Produto: DESOBESI M (CLORIDRATO DE FEMPROPOREX) e DUALID S (CLORIDRATO DE ANFEPRAMONA) Lote, fabricação e validade: Lote: 1200168 e 1100098 (DESOBESI); 0805720 (DUALID) Diferenças: Características do falsificado: Desobesi M – lotes correspondem a outros medicamentos (Exodus e Decongex Plus); Dualid S – lote corresponde ao Mononitrato de Isossorbida / Características do verdadeiro: Não são mais fabricados após a publicação da RDC 52/2011 de 06/10/2011Resolução Específica nº : 04303/2012Data de publicação : 08/10/2012Empresa: Eli Lilly do Brasil Ltda Produto: CIALIS 20mg, blister com 02 comprimidos Lote, fabricação e validade: Lote: Inscrição em baixo relevo 448V-3-13 Diferenças: Características do falsificado: Inscrição em baixo relevo 448V-3-13Informações Adicionais: Mato Grosso do Sul.Medicamentos irregulares em 2016 pela AnvisaMedicamentos Lote/Valide Motivo Resolução EspecíficaQUELANOL, SPARTEQUIM, RENOVY, COMPLEXO EFX BLOCKER, BECALM, GREEN FLUSH E DETOX ONE Todos Comprovação da comercialização de produtos sem registro, notificação ou cadastro na Anvisa Resolução – RE n°. 89, de 14 de janeiro de 2016. D.O.U. n° 10, de 15/01/2016.TADAPOX (dapoxetina + tadalafil) Todos Comprovação da comercialização do medicamento sem registro na Anvisa Resolução – RE n°. 87, de 13 de janeiro de 2016. D.O.U. n° 09, de 14/01/2016.DICLOFENACO SÓDICO 50mg comprimido revestido Todos os lotes produzidos até 19/10/2015 Comprovação de que a empresa implementou alterações nos processos de produção de medicamentos antes da avaliação da Anvisa. Resolução – RE n°. 88, de 13 de janeiro de 2016. D.O.U. n° 09, de 14/01/2016.ESTOLATO DE ERITROMICINA 50mg/mL suspensão oral, NIMESULIDA 50mg/mL suspensão oral Todos Comprovação de que a empresa implementou alterações nos processos de produção de medicamentos antes da avaliação da Anvisa. Resolução – RE n°. 88, de 13 de janeiro de 2016. D.O.U. n° 09, de 14/01/2016.ACICLOVIR, 200mg, comprimido. ALOPURINOL, 100mg e 300 mg, comprimido. BUTILBROMETO DE ESCOPOLAMINA + DIPIRONA SÓDICA, 66,7 mg/mL + 333,4mg/mL, solução oral. CAPTOPRIL, 25mg, comprimido. ESLORATADINA, 0,5mg/mL, xarope. DEXAMETASONA, 0,1mg/mL, elixir. DICLOFENACO DIETILAMÔNIO, 11,6 mg/g, gel. DICLORIDRATO DE CETIRIZINA, 1,0 mg/mL, solução oral. DIPIRONA SÓDICA + CLORIDRATO DE ADIFENINA + CLORIDRATO DE PROMETAZINA, 500mg/1,5ml + 10mg/1,5mL + 5mg/1,5mL, solução oral. FLUCONAZOL, 150 mg, cápsulas. LORATADINA, 1mg/mL, xarope. METRONIDAZOL, 250mg, comprimido revestido. PROPIONATO DE CLOBETASOL, 0,5 mg/g pomada dermatológica. SECNIDAZOL, 1000mg, comprimido revestido. Todos os lotesválidos Recurso Administrativo interposto em face das determinações contidas na Resolução – RE nº 3.148/2015, bem como os estudos apresentados pela empresa quanto aos medicamentos BESILATO DE ANLODIPINO 5 e 10 mg comprimido, CLORIDRATO DE TETRACICLINA 500mg cápsula e TRIANCINOLONA ACETONIDA 1mg/g pomada bucal. Resolução – RE nº 3.367, de 04 de dezembro de 2015. DOU nº 233, de 07/12/2015.CEFALEXINA 500mg, comprimidos, medicamento genérico. 3225286 (Val.: 10/2016) Desvio da qualidade – resultado insatisfatório no ensaio de aspecto. Resolução -RE nº 3.308, de 27 de novembro de 2015. DOU nº 229, de 01/12/2015.ALCACHOFRA 600mg, comprimidos. Especificados na Resolução Inspeção sanitária realizada na empresa onde ficou comprovada a fabricação do medicamento com alteração qualitativa e quantitativa em sua formulação sem anuência prévia da Anvisa. Resolução – RE nº 3.307, de 27 de novembro de 2015. DOU nº 229, de 01/12/2015.HELMIBEN (MEBENDAZOL + TIABENDAZOL) Todos Inspeção sanitária realizada na empresa durante a qual ficou comprovada a fabricação e comercialização do medicamento em desacordo com seu registro por: a) implementação de inclusão de local de fabricação medicamento sem autorização desta Agência e b) implementação de alteração moderada de excipiente semautorização desta Agência; considerando ainda que o registro do medicamento foi cancelado a pedido da empresa. Resolução – RE nº 3.303, de 27 de novembro de 2015. DOU nº 228, de30/11/2015.DYSPNÉ-INHAL (epinefrina) 30 MG/ML SOL P/ INAL CT FR VD AMB X 10 ML e POMADA PARISIENSE (ácido salicílico 20%) Especificados na Resolução Comunicado de recolhimento voluntário encaminhado pela empresa, em razão de haverem alterado o fabricante dos fármacos dos medicamentossem anuência da Anvisa. Resolução – RE nº 3.292, de 27 de novembro de 2015. DOU nº 228, de30/11/2015.CLORIDRATO DE TRAMADOL, 100mg/2mL, solução injetável. 9069057 (Val.: 06/2017) Comunicado de recolhimento voluntário encaminhado pela empresa, em razão da identificação de uma ampola do medicamento FUROSEMIDAinjetável dentro da embalagem secundária do referido lote do medicamento CLORIDRATO DE TRAMADOL, 100mg/2mL, solução injetável. Resolução – RE nº 3.154, de 18 de novembro de 2015. DOU nº 221, de19/11/2015.LEDISOFO (Ledipasvir/Sofosbuvir) 90mg/400mg cápsulas. Todos Comunicado do Lafepe informando o recebimento de notificações solicitando informações sobre a comercialização do medicamento, constando em sua rotulagem como sendo fabricado por ele; considerando que o Laboratório não possui registro para o medicamento em questão, e informou que não fabricou o produto, trata-se, portanto, de falsificação. Resolução – RE nº 3.152, de 17 de novembro de 2015. DOU nº 220, de18/11/2015LOSARTANA POTÁSSICA 100 mg, comprimido revestido. 747759 (Val.: 12/2014) Comunicado de recolhimento voluntário encaminhado pela empresa, em razão da codificação do cartucho estar incorreta, com data de fabricação e validade invertidas (Fab.: 12/2016 e Val.: 12/2014) Resolução – RE nº 3.151, de 17 de novembro de 2015. DOU nº 220, de18/11/2015HYPOCAÍNA 1% (cloridrato de lidocaína) 14010119 (Val.: 01/2016) Detecção de frascos – ampolas do lote do medicamento apresentando corpo estranho em seu interior e a confirmação de que o desvio foi originário do processo de produção. Resolução – RE nº 3.150, de 17 de novembro de 2015. DOU nº 220, de18/11/2015.BACLON (baclofeno), BIOFLEX (dipirona + cloridrato de orfenadrina + cafeína), CLONAZEPAM e CONSTANTE (alprazolam) Todos com prazo de validade vigente Inspeção de pós-registro de medicamentos realizada na empresa, durante a qual foi constatada a produção de medicamentos com alterações pós-registro não autorizadas e, portanto, em desacordo comseus registros na Anvisa. Resolução -RE nº 3.149, de 16 de novembro de 2015. DOU nº 219, de17/11/2015ACICLOVIR, 200mg, comprimido; ALOPURINOL, 300 mg, comprimido; ALUPURINOL, 100mg, comprimido; BESILATO DE ANLODIPINO, 5 e 10mg, comprimido; BUTILBROMETO DE ESCOPOLAMINA + DIPIRONA SÓDICA, 66,7 mg/mL + 333,4mg/mL, solução oral; CAPTOPRIL, 25mg, comprimido; CLORIDRATO DE TETRACICLINA, 500mg, cápsula; DESLORATADINA, 0,5mg/mL, xarope; DEXAMETASONA, 0,1mg/mL, elixir;DICLOFENACO DIETILAMÔNIO, 11,6 mg/g, gel; DICLORIDRATO DE CETIRIZINA, 1,0 mg/mL, solução oral; DIPIRONA SÓDICA + CLORIDRATO DE ADIFENINA + CLORIDRATO DE PROMETAZINA, 500mg/1,5ml + 10mg/1,5mL + 5mg/1,5mL, solução oral; FLUCONAZOL, 150 mg, cápsulas; LORATADINA, 1mg/mL, xarope; METRONIDAZOL, 250mg, comprimido revestido;PROPIONATO DE CLOBETASOL, 0,5 mg/g pomada dermatológica; SECNIDAZOL, 1000mg, comprimido revestido; TRIANCINOLONA ACETONIDA, 1mg/g pomada bucal. Todos Inspeção de pós-registro de medicamentos realizada na empresa, durantea qual foi constatada a produção de medicamentos com alterações pós-registro não autorizadas e, portanto, em desacordo com seus registros na Anvisa. Resolução -RE nº 3.148, de 16 de novembro de 2015. DOU nº 219, de17/11/2015ALTERADA pela Resolução -RE nº 3.367, de 04 de dezembro de 2015. DOU nº 233, de 07/12/2015LETROZOL, 2,5 mg, 30 comprimidos 397733 (Val.: 06/2017) Comunicado de recolhimento voluntário encaminhado pela empresa, em razão de reclamação referente a falha na selagem do alumínio do blíster para o referido lote do medicamento Resolução -RE nº 3.086, de 09 de novembro de 2015. DOU nº 214, de10/11/2015BRAVELLE 75UI Especificados na Resolução Comunicado de recolhimento voluntário encaminhado pela empresa, em razão dos lotes apresentarem valor de potência reduzido após 12 meses de prazo de validade nos testes analíticos do medicamento Resolução -REnº 3.069, de 06 de novembro de 2015. DOU nº 213, de09/11/2015DRAMIN B6 DL solução injetável 10mL 11038662 (Val.: 10/2016) Comunicado de recolhimento voluntário encaminhado pela empresa em razão da presença de partículas visíveis na solução Resolução -RE nº 2.941, de 19 de outubro de 2015. DOU nº 200, de20/10/2015SOLUÇÃO DE CLORETO DE SÓDIO 0,9% 100 mL injetável 808615 (Val.: 02/2017) Desvio da qualidade -Laudo de Análise de amostra única n° 300.000/2015 cujo resultado atestou a insatisfatoriedade no ensaio de aspecto do lote Resolução -RE nº 2.939, de 19 de outubro de 2015. DOU nº 200, de20/10/2015LIVALO 2mg (Pitavastatina Cálcica) 3128743 (Val.: 11/2016) Comunicado encaminhado pela empresa em razão de contaminação cruzada no lote do medicamento pelo ativo Buspirona Resolução -RE nº 2.893, de 15 de outubro de 2015. DOU nº 198, de16/10/2015CIPROFLOXACINO E METRONIDAZOL 5 mg/mL, Solução Injetável Para Infusão Intravenosa, Bolsa Plástica Sistema Fechado 100 ml 0000089664 (Val.: 07/01/2017) Comunicado de recolhimento voluntário encaminhado pela empresa em razão de ter sido identificada uma bolsa do metronidazol dentro de umenvelope impresso como ciprofloxacino para o referido lote do medicamentoMETRONIDAZOL 5 mg/mL Resolução -RE nº 2.888, de 09 de outubro de 2015. DOU nº 195, de13/10/2015TODOS OS MEDICAMENTOS FITOTERÁPICOS(PRODUTOS DIETÉTICOS NUTRIÇÃO INDÚSTRIA E COMÉRCIO LTDA) Todos Comprovação de descumprimento de requisitos de qualidade na fabricação comercialização dos produtos, os quais não possuem registro concedidos por esta Agência e são fabricados por empresa que não possui autorização de funcionamento para tal atividade Resolução -RE nº 2.831, de 08 de outubro de 2015. DOU nº 194, de 09/10/2015TODOS OS PRODUTOS fabricados pela FLORA MÍSTICA NATURALI PRODUTOS NATURAIS LTDA. – ME Todos Resultado insatisfatório obtido em inspeção realizada na empresa, com consequente interdição total do estabelecimento, considerando que a empresa não possui AFE e licença sanitária. Resolução -RE nº 2.744, de 29 de setembro de 2015. DOU nº 187, de30/09/2015BONVIVA (ibandronato de sódio) solução injetável 3mg/3mL H6232H11 (Val.: 12/2015), H6239H18 (Val.: 02/2016), H6244H06 (Val.: 05/2016) e H6259H14 (Val.: 10/2016) Comunicado da empresa sobre detecção de tampas protetoras perfuradas de seringas preenchidas nos lotes do medicamento Resolução -RE nº 2.743, de 29 de setembro de 2015. DOU nº 187, de30/09/2015MENTELMIN (mebendazol), 100 mg, comprimido, blíster com 6 comprimidos Todos Comunicado de recolhimento voluntário enviado pela empresa diante da comprovação da comercialização do medicamento, considerando que essa apresentação foi cancelada a pedido da empresa, por meio da Resolução RE n° 2.201, de 21 de junho de 2013, publicada no D.O.U n° 19, de 24/06/2013, não podendo ser fabricada a partir de então. Resolução -RE nº 2.673, de 22 de setembro de 2015. DOU nº 182, de 23/09/2015VENFORIN 150 MG (CLORIDRATO DE VENLAFAXINA) 688317 (Val.: 10/2016) Detecção de que o referido lote do produto, contém em sua embalagem blisters de outro medicamento -ITRASPOR 100 mg (itraconazol) e o comunicado de recolhimento voluntário encaminhado pela empresa. Resolução -RE nº 2.672, de 22de setembro de 2015. DOU nº 182, de23/09/2015SOLUÇÕES PARENTERAIS DE GRANDE VOLUME E MEDICAMENTOS ESTÉREIS (PHARMACIA ARTESANAL LTDA. FARMOTERÁPICA) Todos Relatório de inspeção realizada pela Vigilância Sanitária de Indaiatuba que considerou a empresa insatisfatória para manipulação de Soluções Parenterais de Grande Volume Resolução -RE nº 2.641, de 18 de setembro de 2015. DOU nº 180, de21/09/2015Todos da empresa INFAN -INDÚSTRIA QUÍMICA E FARMACÊUTICA NACIONAL S.A. Todos Relatórios de inspeções de Boas Práticas de Fabricação realizadas em 29 de dezembro de 2014 e 30 de julho de 2015 que concluíram que a empresa se encontra em condição técnico operacional satisfatória para as linhas de sólido e semi sólido, que mantém sob estado de controle um sistema de qualidade dos parâmetros definidos na fabricação de medicamentos e reúne condições técnicas operacionais, para produção de medicamentos líquidos, sólidos, incluindo sólidos especiais, semissólidos e líquidos biológicos. Resolução -RE nº 2.595, de 11 de setembro de 2015 DOU nº 175, de 14/09/2015ALBENDAZOL 400mg, comprimidos 1409579 (Val.: 08/2016) Desvio da qualidade – resultado insatisfatório no ensaio de dissolução do medicamento Resolução -RE nº 2.542, de 04 de setembro de 2015. DOU nº 171, de08/09/2015CLORIDRATO DE METFORMINA 850mg, comprimido 13L829 Desvio da qualidade – resultado insatisfatório nos ensaios de aspecto e descrição da amostra, por apresentar comprimidos com mancha irregular e pontos de cor preta Resolução -RE nº 2.480, de 02 de setembro de 2015. DOU nº 170, de04/09/2015METRONIDAZOL 250mg, comprimido 13L95F (Val.: 12/2015) Desvio da qualidade – resultado insatisfatório nos ensaios de aspecto e descrição da amostra, por apresentar comprimidos com mancha irregular e pontos de cor preta Resolução -RE nº 2.479, de 02 de setembro de 2015. DOU nº 170, de04/09/2015ALBENDAZOL 400mg comprimidos, medicamento genérico L14H6F1(Val.: 09/2016) Desvio da qualidade – resultado insatisfatório no ensaio de dissolução do medicamento Resolução-RE nº 2.478, de 02 de setembro de 2015. DOU nº 169, de 03/09/2015EVOTERIN (cloridrato de irinotecano tri-hidratado), apresentações de 40 mg (20 MG/ML SOL INJ CT FA VD AMB X 2 ML) e 100mg (20 MG/ML SOL INJ CT FA VD AMB X 5 ML) Especificados na Resolução Comunicado de recolhimento voluntário da empresa detentora do registro, em razão de ter recebido reclamações envolvendo a presença de precipitados nos frascos do medicamento Resolução -RE nº 2.476, de 1° de setembro de 2015. DOU nº 168, de02/09/2015AKINETON 2 mg (cloridrato de biperideno), 80 comprimidos e AKINETON 4 mg RETARD (cloridrato de biperideno), 30 comprimidos revestidos 1006257 (Val 03/08/2018), 1006305 (Val 15/08/2018), 1006596 (Val 15/08/2018), 1006597 (Val 01/09/2018), 1006674 (01/09/2018) e 1006180 (Val 25/07/2018), 1006304 (Val 25/07/2018), respectivamente Desvio da qualidade – comunicado de recolhimento voluntário encaminhadopela empresa devido à troca de bulas entre as apresentações do medicamento. Resolução -RE nº 2.441, de 28 de agosto de 2015. DOU nº 166, de 31/08/2015CLORETO DE SÓDIO A 0,9%, 1000 mL 0000081766 (Val 09/12/2015) Desvio da qualidade – resultado insatisfatório no ensaio de esterilidade por ter sido verificada a presença de Bacillus megaterium Resolução – RE n° 2.409, de 24 de agosto de 2015. D.O.U. n° 162, de25/08/2015.Medicamentos da empresa LABORATÓRIO BELÉM JARDIM INDÚSTRIA E COMÉRCIO LTDA especificados na resolução Todos os fabricados a partir de 24/06/2011 Relatório de Inspeção Sanitária emitido em 26 de junho de 2015 pela DVMC- MG, que concluiu pela interdição cautelar dos produtos e da empresa por não seguir as boas práticas de fabricação. Resolução-RE n° 2.269, de 12 de agosto de 2015. D.O.U. n° 154, de 13/08/2015SLIM PATCH Todos Comprovação da divulgação irregular do produto, que não possui registro nesta Agência, por meio do endereço eletrônico www.stekimports.com.br, bem como da comercialização irregular em outros sítios eletrônicos de compras coletivas. Resolução-RE n° 2.268, de 12 de agosto de 2015. D.O.U. n° 154, de13/08/2015.MENTELMIN (mebendazol), 20 mg/mL, suspensão oral Todos Comprovação da comercialização de apresentação cancelada do medicamento, publicada no D.O.U n° 119, de 24/06/2013 por meio daResolução RE n° 2.201, de 21 de junho de 2013, não podendo ser fabricada a partir da data da publicação. Resolução -RE n°. 2.267, de 10 de agosto de 2015. D.O.U. n° 153, de12/08/2015.VASOPRIL comprimido, 5 e 10 mg Todos Comprovação da comercialização do produto, com os registros cancelados na Anvisa desde setembro e outubro de 2013, respectivamente. Resolução -RE n°. 2.266, de 10 de agosto de 2015. D.O.U. n° 153, de12/08/2015.ESPIRINOLACTONA 100 mg, comprimido, marca ALDOSTERIN D713005 Laudos de Análise Fiscal de amostra única n.º 2821.00/2014, 2822.00/2014, 2820.00/2014, 2819.00/2014 e 2818.00/2014, emitidos pelo Instituto Adolfo Lutz, que apresentaram resultados insatisfatórios nos ensaios de descrição da amostra e aspecto. Resolução-RE nº 2.172, de 31 de julho de 2015. D.O.U. 146, de 03/08/2015HUANG HE -VIGOR VIRIL -TOTALMENTE NATURAL Todos Presença de susbtância não aprovada Resolução-RE nº 2.171, de 31 de julho de 2015. D.O.U. 146, de 03/08/2015BIOFOR C, BIOVITAZINCO, BIOVITA C 1g e BIOVITA C 2g Todos os lotes entre janeiro e dezembro de 2014 Desvio da qualidade – alteração de aspecto e efervescência Resolução-RE nº 2.170, de 31 de julho de 2015. D.O.U. 146, de 03/08/2015………………”A equipe do JORNAL DO OESTE entrou em contato com a Assessoria de Imprensa da Prati Donaduzzi, mas até o fechamento…”, continue lendo em: https://www.jornaldooeste.com.br/noticia/anvisa-determina-suspensao-de-lotes-de-medicamentos-da-prati-donaduzzi


 Doutor em Saúde Coletiva, Jarbas Barbosa ocupa o cargo político de diretor-presidente da Anvisa desde 2015: falta de fiscalização e vistas grossas para as fraudes e aberrações aconteçam no setor farmacêutico
Doutor em Saúde Coletiva, Jarbas Barbosa ocupa o cargo político de diretor-presidente da Anvisa desde 2015: falta de fiscalização e vistas grossas para as fraudes e aberrações aconteçam no setor farmacêutico